科研动态
51直播
近日,北京大学心血管研究所冼勋德研究员课题组在期刊Nature Communications杂志上发表了题为“SR-A3 suppresses AKT activation to protect against MAFLD by inhibiting XIAP-mediated PTEN degradation”的文章,首次系统性地揭示了SR-A3在调控AKT信号通路中和肝脏糖脂代谢中的重要作用,并阐明了其在MAFLD治疗中的重要作用。

代谢相关脂肪性肝病(MAFLD)作为临床上极为常见的慢性肝病,正以惊人的速度在全球范围内蔓延。如今,其患病率约占全球人口总数的30%,给各个国家和地区的经济与医疗卫生行业造成沉重负担。MAFLD并非孤立存在,它常常与糖尿病、高脂血症以及胰岛素抵抗等病症相伴而生,是代谢综合征在肝脏的典型表现,具有发病率高、病程漫长且疾病谱广泛的特点。尽管医疗技术不断进步,但目前针对 MAFLD 的靶向药物屈指可数,仅有甲状腺激素β受体激动剂 Resmetirom 获美国FDA批准上市用于治疗代谢相关脂肪性肝炎MASH。因此,迫切需要探寻新的治疗MAFLD靶点并深入阐明其作用机制,以减轻MAFLD带来的经济和社会负担。
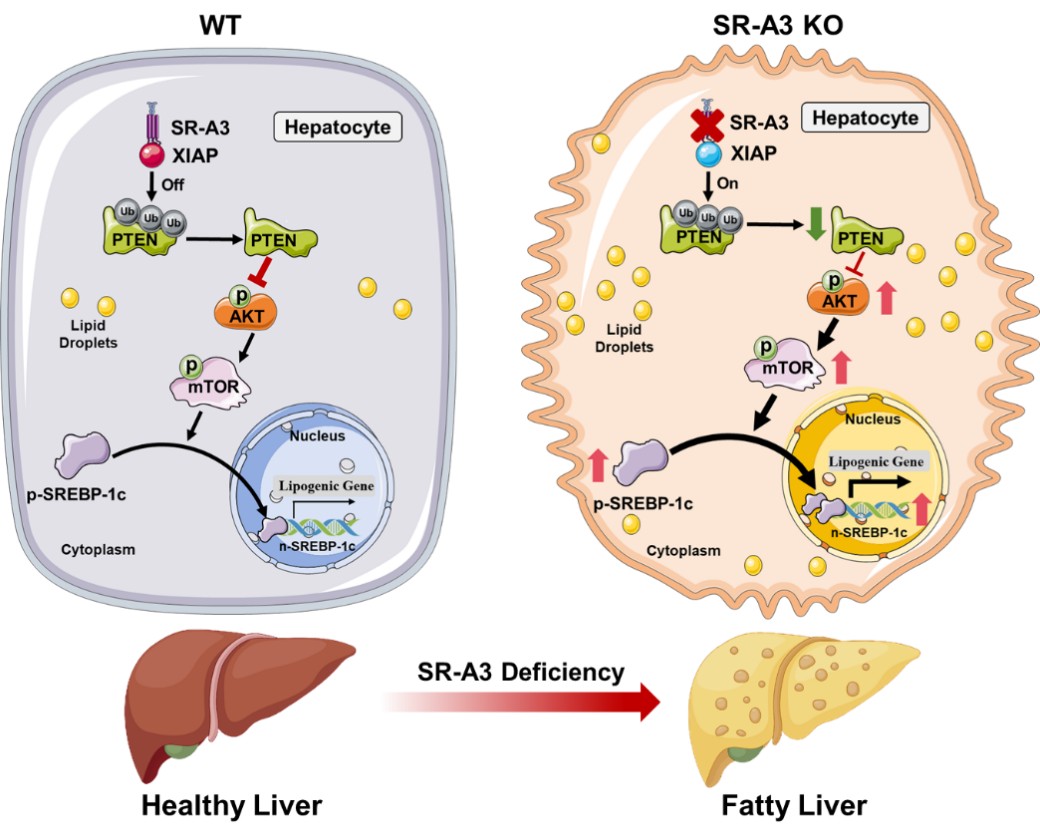
该研究将目光聚焦于A类清道夫受体家族成员3(SR-A3)这一在糖脂代谢领域鲜少被关注却极具潜力的靶点。与经典的脂蛋白受体不同,SR-A3不含有脂蛋白结合结构域,定位于内质网和高尔基体,提示可能存在独立于传统脂蛋白转运的功能。本项目首次系统性地揭示了SR-A3在调控AKT信号通路中和肝脏糖脂代谢中的重要作用,并阐明了其在MAFLD治疗中的重要作用。
研究团队通过对MAFLD患者样本以及多种啮齿动物MAFLD模型的联合分析发现,在MAFLD患者及啮齿动物的肝脏中SR-A3表达水平显著低于健康对照,其缺失会引起胰岛素抵抗、高脂血症和肝脏脂质蓄积、炎症和纤维化。进一步的实验表明,在全身性敲除SR-A3基因仓鼠模型中,可观察到自发性肝脂肪变性,在高脂高胆固醇饮食的诱导下进一步加剧肝脏损伤。此外,利用腺相关病毒8(AAV8)在啮齿类动物肝脏中过表达人SR-A3基因,实验结果显示,SR-A3可以显著抑制由HFHCD诱导的仓鼠胰岛素抵抗、高脂血症和MAFLD的发生,为SR-A3作为治疗MAFLD的有效靶点提供了有力的证据。
分子机制研究揭示了SR-A3通过抑制E3泛素连接酶XIAP介导的PTEN泛素化和降解,阻止AKT信号通路的过度激活,从而下调了Srebp1c介导的肝脏脂质从头合成。当SR-A3功能受损时,XIAP促进PTEN蛋白的泛素化降解,引起AKT的过度磷酸化,从而促进Srebp1c入核调控脂质生成相关基因的转录和表达。SR-A3对肝脏的保护作用兼具物种普适性和药物干预可行性。
本研究的创新之处在于,首次系统地揭示了SR-A3在肝脏糖脂代谢中的作用及具体分子机制;并通过靶向调控肝脏中SR-A3的表达来保护MAFLD的发生和发展。SR-A3精准调控 XIAP/PTEN/AKT 轴,抑制下游 SREBP-1c 介导的肝脏脂质从头合成,有效减轻肝脏脂质蓄积;同时,SR-A3 还能在不同程度上缓解胰岛素抵抗和高甘油三酯血症等 MAFLD 常见的合并症。与现有的治疗手段相比,以 SR-A3 为靶点进行治疗,不仅能够从关键代谢通路入手改善肝脏脂质代谢,阻止 MAFLD 的病情进展,还为 MAFLD相关代谢综合症如2型糖尿病和冠心病等的治疗提供了新的方向和理论依据,具有重要的潜在应用价值。这一发现为应对全球MAFLD及相关代谢疾病高发和高致死率问题带来了希望,同时也为探索更广泛的代谢性疾病治疗奠定了重要基础。未来,围绕 SR-A3 展开的进一步研究和相关药物开发,将为全球范围内数百万代谢综合征患者带来福音。
北京大学心血管研究所冼勋德研究员为本文通讯作者。博士生赖苹苹,博士后苗国琳、博士生韩雨非和赵音琪为本文共同第一作者。本研究得到刘国庆教授的指导,受到国家自然科学基金委项目资助和血管稳态与重构全国重点实验室的大力支持。
原文链接:
//www.nature.com/articles/s41467-025-57585-0

